Page 15 - eEC10210-_普通化學(下)_課本PDF
P. 15
第 10 章
熱化學
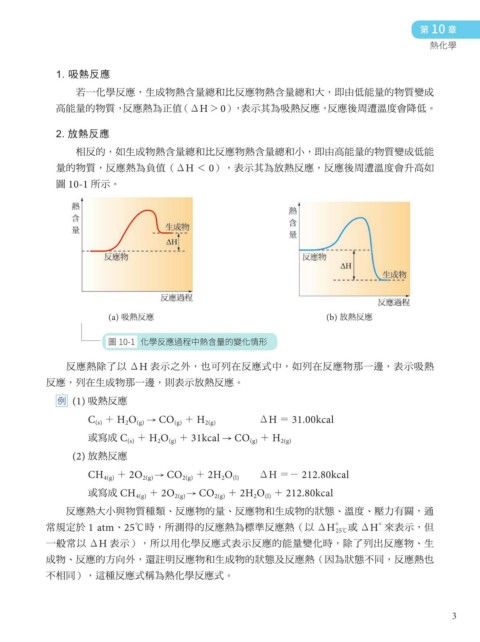
1. 吸熱反應
若一化學反應,生成物熱含量總和比反應物熱含量總和大,即由低能量的物質變成
高能量的物質, 反應熱為正值 (ΔH > 0), 表示其為吸熱反應, 反應後周遭溫度會降低。
2. 放熱反應
相反的,如生成物熱含量總和比反應物熱含量總和小,即由高能量的物質變成低能
量的物質,反應熱為負值(ΔH < 0),表示其為放熱反應,反應後周遭溫度會升高如
圖 10-1 所示。
(a) 吸熱反應 (b) 放熱反應
圖 10-1 化學反應過程中熱含量的變化情形
反應熱除了以 ΔH 表示之外,也可列在反應式中,如列在反應物那一邊,表示吸熱
反應,列在生成物那一邊,則表示放熱反應。
(1) 吸熱反應
例
C (s) + H O CO (g) + H 2(g) ΔH = 31.00kcal
2
(g)
或寫成 C (s) + H O (g) + 31kcal CO (g) + H 2(g)
2
(2) 放熱反應
CH 4(g) + 2O 2(g) CO 2(g) + 2H O ΔH =- 212.80kcal
(l)
2
或寫成 CH 4(g) + 2O 2(g) CO 2(g) + 2H O + 212.80kcal
2
(l)
反應熱大小與物質種類、反應物的量、反應物和生成物的狀態、溫度、壓力有關,通
常規定於 1 atm、25℃時,所測得的反應熱為標準反應熱(以 ΔH° 或 ΔH°來表示,但
25℃
一般常以 ΔH 表示),所以用化學反應式表示反應的能量變化時,除了列出反應物、生
成物、反應的方向外,還註明反應物和生成物的狀態及反應熱(因為狀態不同,反應熱也
不相同),這種反應式稱為熱化學反應式。
3
౷ஷʷኪ ɨ DI JOEE ɨʹ